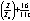 sekunnissa. Käytännössä
tämä merkitsee sitä, että kun fluoresoivaa materiaalia valaistaan
(viritetään) ultraviolettialueen säteilylähteellä, nähdään tuloksena
materiaalille ominaisia fluoresoivia värejä.
sekunnissa. Käytännössä
tämä merkitsee sitä, että kun fluoresoivaa materiaalia valaistaan
(viritetään) ultraviolettialueen säteilylähteellä, nähdään tuloksena
materiaalille ominaisia fluoresoivia värejä.Fluoresenssi on eräs luminesenssin esiintymismuoto. Fluoresenssiksi
kutsutaan parillisten spinien muodostaman elektronisysteemin virittymisen
laukeamista. Tällainen kvanttimekaniikan mukaisesti sallittu transitio
purkautuu tyypillisesti n. 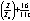 sekunnissa. Käytännössä
tämä merkitsee sitä, että kun fluoresoivaa materiaalia valaistaan
(viritetään) ultraviolettialueen säteilylähteellä, nähdään tuloksena
materiaalille ominaisia fluoresoivia värejä.
sekunnissa. Käytännössä
tämä merkitsee sitä, että kun fluoresoivaa materiaalia valaistaan
(viritetään) ultraviolettialueen säteilylähteellä, nähdään tuloksena
materiaalille ominaisia fluoresoivia värejä.
Fluoresenssi on ilmiönä tunnettu joitakin satoja vuosia, mutta vasta auringon valon simulointiin tarkoitettujen valonlähteitten, ultraviolettisuotimien, mittalaitteitten ja mittayksikköjärjestelmän kehittymisen myötä ilmiötä on alettu tutkia järjestelmällisesti. Tämän tuloksena on fluoresenssia ja fluoresoivia värejä löydetty luonnosta monesta erilaisesta paikasta niin maalla kuin merelläkin. Lääketieteessä maneetin vihreää fluoresoivaa proteiinia käytetään apuna monessa erilaisessa tutkimuksessa, kuten esimerkiksi geenitutkimuksessa. Fluoresoivia timantteja ja mineraaleja käytetään koruina ja koristeina erilaisissa ympäristöissä. Biologit pyrkivät saamaan lisää tietoa eliöistä fluoresoivien värien avulla, kuten merieliöiden fluoresenssi ja skorpionien fluoresoivat ominaisuudet.
Myös teollisuus on hyödyntänyt fluoresoivien värien ominaisuuksia. Metalliteollisuudessa fluoresoivia värejä käytetäänkin laaduntarkkailussa perustuen ihmisen silmän herkkyyteen pimeässä tietyille aallonpituuksille. Paperiteollisuudessa fluoresoivia värejä käytetään paperin valkoisuusaistimuksen parantamiseen. Rikosten ja yleisen turvattomuuden lisääntyminen on tuonut asiakirjoihin ja seteleihin fluoresoivia värejä käyttävät turvamerkinnät. Automäärien kasvu maanteillä on lisännyt tarvetta parantaa liikenneopasteiden näkyvyyttä ääriolosuhteissa, jolloin uusia kestäviä fluoresoivia materiaaleja käyttämällä voidaan tehdä entistä havaittavampia liikennemerkkejä. Kuluneen vuoden aikana fluoresoivat värit ovat tulleet mukaan myös tiedontallennukseen ja fluoresoivia värejä käyttävän tiedontallennuslaitteen ennustetaankin syrjäyttävän perinteiset tallennusmediat muutaman vuoden aikana.
Lukuisat fluoresoivien värien teolliset sovellukset ja luonnossa esiintyvät fluoresenssit ovatkin johtaneet tarpeeseen kehittää fluoresoivien värien mittausmenetelmiä entistä tarkemmiksi ja yhtenäisemmiksi.
Tutkielmani käsittelee fluoresoivien värien mittaukseen liittyviä tekijöitä kuten erilaisia mittalaitteita, niihin liittyviä suureita, valonlähteitä, mittaustekniikoita, näihin liittyviä virheitä ja niiden analysointia. Edelleen käydään läpi fluoresoiviin väreihin liittyviä standardeja ja metrologiaa. Kahdessa viimeisessä kappaleessa käyn esimerkkien kautta läpi fluoresoivien värien ilmiöitä luonnossa sekä fluoresoivien värien sovelluksia teollisuudessa.
Fluoresenssi on fysikaalisena ilmiönä eräs luminesenssin esiintymismuoto. Luminesenssilla ymmärretään virittyneen tilan energian tai rekombinoitumisessa vapautuvan energian emittoitumista sähkömagneettisena säteilynä.
Luminesenssi jaetaan kahteen eri tyyppiin sen mukaan millaiset perus- ja viritystilat ovat. Virittyneessä singlettitilassa elektronilla on perustasoa korkeampienergisellä tasolla vastakkainen spin verrattuna toiseen elektroniin, joka on alemmalla energiatasolla eli elektronit ovat parilliset. Triplettitilassa nämä elektronit ovat parittomia eli niiden spinit ovat saman suuntaiset. Singlettitilan spinin ei tarvitse muuttaa suuntaansa palautuessaan takaisin perustilaan virittyneestä tilasta. Triplettitilan spiniltä tuo suunnanmuutos kuitenkin vaaditaan.
Fluoresenssiksi kutsutaan parillisten spinien muodostaman
elektronisysteemin virittymisen laukeamista. Tällainen kvanttimekaniikan
mukaisesti sallittu transitio purkautuu tyypillisesti n. 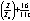 sekunnissa eli emissionopeus on n.
sekunnissa eli emissionopeus on n.  1/s. Tämä
elinikä on se aika, jonka fluoresoiva aine keskimäärin kuluttaa siihen,
että viritys laukeaa.
1/s. Tämä
elinikä on se aika, jonka fluoresoiva aine keskimäärin kuluttaa siihen,
että viritys laukeaa.
Fosforesenssiksi kutsutaan emissiota, joka seuraa transitioista erilaisten kerrannaisuuksien omaavien tilojen välillä. Tyypillisesti kyse on triplettitilan palautumisesta perustilaansa. Tällaiset transitiot eivät ole sallittuja ja emissionopeus on pieni. Tyypillisesti fosforesenssin eliniät ovat millisekunneista sekunteihin riippuen keskeisesti muista virityksen laukeamiseen liittyvistä prosesseista kuin emissiosta.
Virityksen laukeamiseen kuluvan ajan mukaisesti erilaiset luminesenssin lajit voidaan jakaa kuvan 2.1 kaavion mukaisesti.
Tässä yhteydessä tarkastellaan vain fluoresenssia. Optisissa mittauksissa varsinkin orgaanisten yhdisteiden ja biologisten muuttujien osalta fluoresenssi on otettava huomioon mittausjärjestelyjä suunniteltaessa.
Sähkömagneettisen säteilyn absorptiota väliaineeseen ja emissiota
väliaineesta kuvataan usein nk. Jablonskin diagrammeilla. Kuvassa 2.2 on
esitetty eräs Jablonskin diagrammi, jossa on
esitetty elektronien perustila 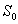 sekä tilat
sekä tilat 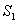 ja
ja 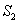 . Jokainen näistä tasoista voi pitää sisällään
useita värähtelytasoja, jotka merkitty numeroilla 0, 1, 2 ja niin
edelleen.
. Jokainen näistä tasoista voi pitää sisällään
useita värähtelytasoja, jotka merkitty numeroilla 0, 1, 2 ja niin
edelleen.
Transitiot eri elektronitasojen välillä ovat vertikaalisia. Tällä
kuvataan valon absorption hetkellistä luonnetta. Absorption tarvitsema
aika on noin 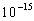 sekuntia, joka on riittävän pieni
siihen, ettei molekyylissä esiinny ydintenvälisiä siirtymiä. Tätä
kutsutaan Frank-Condonin periaatteeksi.
sekuntia, joka on riittävän pieni
siihen, ettei molekyylissä esiinny ydintenvälisiä siirtymiä. Tätä
kutsutaan Frank-Condonin periaatteeksi.
Valon absorptiosta seuraa yleensä useita erilaisia prosesseja.
Tyypillisesti fluoresoiva materiaali virittyy jollekin korkeammalle
vibraatiotasolle elektronitasoilla 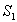 ja
ja 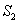 .
Joissakin harvinaisissa tapauksissa molekyylin virittynyt elektroni palautuu
nopeasti tason
.
Joissakin harvinaisissa tapauksissa molekyylin virittynyt elektroni palautuu
nopeasti tason 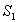 alimmalle vibraatiotasolle. Tätä
kutsutaan sisäiseksi konversioksi ja yleensä se tapahtuu noin
alimmalle vibraatiotasolle. Tätä
kutsutaan sisäiseksi konversioksi ja yleensä se tapahtuu noin 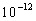 sekunnissa. Kun fluoresenssin elinaika on n.
sekunnissa. Kun fluoresenssin elinaika on n. 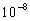 ekuntia tapahtuu sisäinen konversio yleensä täydellisesti ennen emissiota.
Fluoresenssin emissio tapahtuu termisesti
tasapainottuneesta tilasta käsin. Kuten absorptiokin, elektronisen
transition purkautuminen tuottaa myös virittyneen vibraatiotason. Myös
tämä taso hakeutuu termiseen tasapainoon noin
ekuntia tapahtuu sisäinen konversio yleensä täydellisesti ennen emissiota.
Fluoresenssin emissio tapahtuu termisesti
tasapainottuneesta tilasta käsin. Kuten absorptiokin, elektronisen
transition purkautuminen tuottaa myös virittyneen vibraatiotason. Myös
tämä taso hakeutuu termiseen tasapainoon noin 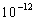 sekunnissa.
sekunnissa.
Molekyylin absorptiospektri kuvaa elektronisesti virittyneiden tilojen vibraatiotasoja ja emissiospektri kuvaa perustilan vibraatiotasoja. Yleisellä tasolla elektroninen viritys ei suurestikaan muuta vibraation energiatasojen sijaintia. Voidaan sanoa, että vibraatioiden rakenteet ovat samanlaisia niin absorptiossa kuin emissiossakin.
Molekyylit tilassa 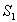 voivat myös läpikäydä
konversion ensimmäiselle triplettitilalle
voivat myös läpikäydä
konversion ensimmäiselle triplettitilalle 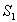 . Emissio
tilalta
. Emissio
tilalta 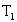 perustilalle on kielletty. Tällaisen tilan
purkautuminen on muutamia
kertaluokkia hitaampaa kuin fluoresenssin. Tätä ilmiötä kutsutaan
fosforesenssiksi.
perustilalle on kielletty. Tällaisen tilan
purkautuminen on muutamia
kertaluokkia hitaampaa kuin fluoresenssin. Tätä ilmiötä kutsutaan
fosforesenssiksi.
Fluoresenssin emissiospektrin ominaisuuksista on huomattava
Stokes-siirtymä, jolla tarkoitetaan sitä, että emissio havaitaan
poikkeuksetta pitemmillä aallonpituuksilla kuin absorptio eli
prosessissa häviää energiaa. Eräs syy tähän on elektronien nopea
vaimeneminen 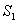 :n alemmalle vibraatiotasolle. Tämän
lisäksi fluoresoivat materiaalit vaimenevat virittyneille
:n alemmalle vibraatiotasolle. Tämän
lisäksi fluoresoivat materiaalit vaimenevat virittyneille 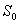 :n
tasoille. Stokes havaitsi ilmiön vuonna 1852 kuvan 2.3 koejärjestelyllä.
:n
tasoille. Stokes havaitsi ilmiön vuonna 1852 kuvan 2.3 koejärjestelyllä.
UV-valonlähteenä toimi auringonvalo ja sininen lasisuodin. Eksitaatiovalon pääsy detektorille estettiin keltaisella viinilasilla. Kiniinin fluoresenssipiikki on 450 nm kohdalla (kuva 2.4) ja havaitaan täten selvästi paljaalla silmällä.
Näiden ilmiöiden lisäksi fluoresoivat aineet voivat ilmaista suurempaa Stokes-siirtymää johtuen liukenemisilmiöistä sekä viritystilojen reaktioista.
Kaasufaasissa Stokes-siirtymää ei aina havaita. Siirtymättömiä emissioita voidaan havaita silloin kun kaasun konsentraatiot ovat suhteellisen pieniä, jolloin molekyylit eivät törmää keskenään muiden molekyylien kanssa ennen emissiota. Tällaiset törmäykset ovat virittymisen purkautumisen lähde. Nestefaasissa törmäykset ovat jatkuvia.
Sama fluoresenssin emissio on yleensä havaittavissa riippumatta
virittävän säteilyn aallonpituudesta. Virityksen aikana korkeampien
elektroni- ja vibraatiotasojen energia kuluu nopeasti,
jättäen fluoresoivan aineen alimmalle 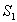 :n
vibraatiotasolle. Tämä relaksaatio tapahtuu noin
:n
vibraatiotasolle. Tämä relaksaatio tapahtuu noin 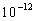 sekunnissa ja on todennäköisesti tulosta vahvasta päällekkäisyydestä
useiden tilojen
kesken, joilla on jokseenkin sama energia. Tästä nopeasta relaksaatiosta
johtuen emissiospektri on riippumaton virittävästä aallonpituudesta.
sekunnissa ja on todennäköisesti tulosta vahvasta päällekkäisyydestä
useiden tilojen
kesken, joilla on jokseenkin sama energia. Tästä nopeasta relaksaatiosta
johtuen emissiospektri on riippumaton virittävästä aallonpituudesta.
Poikkeuksena edellisestä jotkin aineet, kuten atsuleeni, voivat
emittoida molemmilta tasoilta 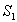 ja
ja 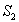 .
Lisäksi absorptiospektrin erittäin voimakkaan punareunan viritys tuottaa
punasiirtyneen emission. Tämä johtuu siitä, että punareunan viritys
virittää ne fluoroforit, jotka voivat reagoida voimakkaimmin
vuorovaikutuksessa liuottimen kanssa.
.
Lisäksi absorptiospektrin erittäin voimakkaan punareunan viritys tuottaa
punasiirtyneen emission. Tämä johtuu siitä, että punareunan viritys
virittää ne fluoroforit, jotka voivat reagoida voimakkaimmin
vuorovaikutuksessa liuottimen kanssa.
Fluoresenssin emissiospektrissä ilmenee peilikuvailmiö, joka tarkoittaa
sitä, että fluoresenssin emissiospektri on peilikuva absorptiospektristä.
Tämä ilmiö esiintyy varsinkin silloin kun
absorptio tapahtuu transitiona tasolta 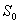 tasolle
tasolle
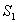 .
.
Spektrien symmetrisyys johtuu siitä, että samat transitiot osallistuvat
niin absorptioon kuin emissioonkin sekä 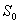 ja
ja 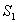 tasojen vibraatioenergioiden samankaltaisuuksista. Monissa
molekyyleissä nämä energiatasot eivät ole merkittävästi muuttuneet
erilaisten
tasojen vibraatioenergioiden samankaltaisuuksista. Monissa
molekyyleissä nämä energiatasot eivät ole merkittävästi muuttuneet
erilaisten 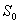 :n ja
:n ja 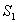 elektronijakautumien vaikutuksesta.
elektronijakautumien vaikutuksesta.
Franck-Condonin periaatteen mukaan kaikki elektronien transitiot ovat vertikaalisia, mikä tarkoittaa sitä, ettei ydinten asema muutu. Tästä seuraa, että mikäli tietyn transition todennäköisyys nollannen ja toisen vibraatiotason välillä on suurin absorptiossa, käänteinen transitio on yhtä todennäköinen emissiossa. Tätä transition todennäköisyyttä kutsutaan myös Frank-Condonin tekijäksi. Kuvassa 2.5 on esitetty kuvat peilikuvailmiöstä ja Frank-Condonin tekijästä.
Peilikuvasäännön täsmällinen testaaminen edellyttää, että niin
absorptio- kuin emissiospektrikin on esitettävä sopivissa yksiköissä.
Lähimmäksi symmetriaa pitäisi päästä silloin kun
käytetään sovitettuja spektrejä 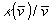 ja F
ja F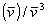 ,
missä
,
missä 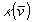 on vaimennuskerroin aaltoluvulle
on vaimennuskerroin aaltoluvulle 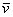 ja F
ja F on suhteellinen fotonivuo yli aaltolukuvälin
on suhteellinen fotonivuo yli aaltolukuvälin
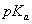 . Näiden kahden
spektrin yhteensovitus on yleensä löydettävissä polynukleaarisille
aromaattisille hiilivedyille.
. Näiden kahden
spektrin yhteensovitus on yleensä löydettävissä polynukleaarisille
aromaattisille hiilivedyille.
Peilikuvasääntöön on olemassa myös poikkeuksia. Esimerkiksi bifenyylin absorptiospektrissä ei ole havaittavissa rakennetta, mutta emissiospektrissä vibraatiotasot erottuvat selvästi.
Nämä peilikuvasäännön puutteet kertovat yleensä siitä, että ytimellä on
erilainen geometrinen muoto viritetyssä tilassa kuin perustilassa. Ydinten
poikkeamat ovat mahdollisia johtuen 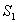 tilan
suhteellisen pitkästä elinajasta. Tässä bifenyylin tapauksessa siis
emissiospektri on hienojakoisempi kuin absorptiospektri, mikä on
poikkeuksellista. Yleensä asia on juuri
päinvastoin.
tilan
suhteellisen pitkästä elinajasta. Tässä bifenyylin tapauksessa siis
emissiospektri on hienojakoisempi kuin absorptiospektri, mikä on
poikkeuksellista. Yleensä asia on juuri
päinvastoin.
Myös muut virittyneiden tilojen reaktiot kuin geometriset siirtymät
voivat aiheuttaa poikkeuksia peilikuvasääntöön. Esimerkiksi fenoli ja
tyrosiini antavat kumpikin kaksi emissiota. Pitkän
aallonpituuden emissio on seurausta suuresta protoniakseptoreiden
määrästä. Fenolihydroksyyliryhmän happovakio 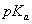 laskee perustilan 11:sta viritetyn tilan 4:ään. Virittymisessä
fenolin protonit menettävät protoniakseptoreita liuokseen. Riippuen näiden
akseptoreiden konsentraatiosta fenoli tai fenolaatti voi dominoida
emissiospektriä.
laskee perustilan 11:sta viritetyn tilan 4:ään. Virittymisessä
fenolin protonit menettävät protoniakseptoreita liuokseen. Riippuen näiden
akseptoreiden konsentraatiosta fenoli tai fenolaatti voi dominoida
emissiospektriä.
Vaikka useat polynukleaariset aromaattiset hiilivedyt ovat vailla reagoivia ryhmiä, ne käyvät myös läpi virittyneiden tilojen reaktioita. Esimerkiksi viritetty pyriini muodostaa varauksenkuljettajakompleksin itsensä kanssa. Polynukleaariset aromaattiset hiilivedyt voivat muodostaa varauksenkuljettajia myös muiden hiilivetymolekyylien kanssa.
Molekyylien fluoresenssia tarkasteltaessa on huomattava, että perustilan alimmalta tasolta viritetyn tilan alimmalle tasolle tapahtuvalla absorptiolla on sama aallonpituus kuin vastaavalla emissiolla. Kyseessä on nk. Resonanssifluoresenssi eli sisäinen fluoresenssi. Tätä havaitaan vain harvoin, sillä se vaikuttaa molekyylin sisällä.
Fluoresenssispektrejä tarkasteltaessa on otettava huomioon
Stokes-siirtymän lisäksi myös sironnat ja anti-Stokes -siirtymä.
Anti-Stokes -siirtymä syntyy kun absorptio esiintyy
alemmasta 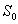 :n vibraatiotasosta, jolloin emittoituvan
säteilyn aallonpituus on lyhyempi kuin virittävän säteilyn.
:n vibraatiotasosta, jolloin emittoituvan
säteilyn aallonpituus on lyhyempi kuin virittävän säteilyn.
Aineet, joissa fluoresenssia esiintyy, voidaan jakaa kahteen luokkaan fluoresenssin tyypin mukaan. Aineessa voi esiintyä luonnollista fluoresenssia tai fluoresenssi esiintyy vain jos siihen kohdistetaan sähkömagneettista säteilyä ulkoapäin.
Luminesenssiin sisältyy fluoresenssin ja fosforesenssin lisäksi muitakin ilmiöitä, jotka esitellään tarkemmin ilmiöihin liittyvissä luvuissa.